Raíz principal de caquizeiro, planta com sintoma de declínio, mostrando morte dos vasos, escurecimento e ausência de raízes secundárias. Fazenda Souza, Caxias do Sul, RS, dezembro 2018.
Raíz principal de caquizeiro, planta com sintoma de declínio, mostrando morte dos vasos, escurecimento e ausência de raízes secundárias. Fazenda Souza, Caxias do Sul, RS, dezembro 2018.
Planta de caquizeiro (Diospyros kaki L.), pomar com ca. 4500 árvores, 22 anos de idade, Fazenda Souza, Caxias do Sul, RS, com folhas com verde fraca, sintoma inicial de declínio, cuminando com a morte, ao longo de 3-4 anos.
Plantas de caquizeiro (Diospyros kaki L.) aparentemente normal, pomar com ca. 4500 árvores e 22 anos, Fazenda Souza, Caxias do Sul, RS, dezembro 2019.
Ramo de caquizeiro (Diospyros kaki L.) raspado indicando ausência de tecidos escuros, ou seja, sem sintoma de cancro, Fazenda Souza, Caxias do Sul, RS, dezembro 2019.
Ramo de caquizeiro (Diospyros kaki L.) raspado indicando ausência de tecidos escuros, ou seja, sem sintoma de cancro, Fazenda Souza, Caxias do Sul, RS, dezembro 2019.
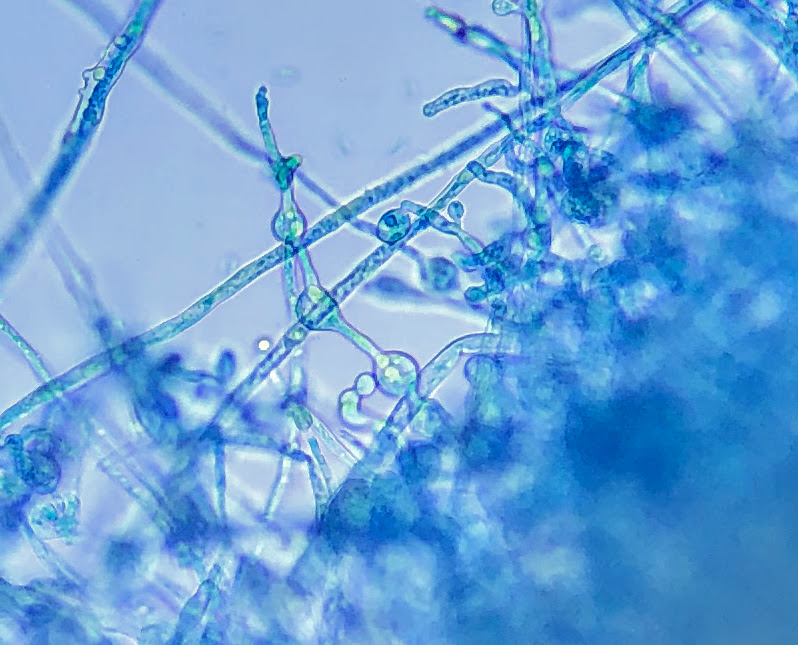
Clamidosporos (conjunto de três) em hifa de fungo isolado em meio de cultura a partir dos tecidos das raízes de caquizeiro, Fazenda Souza, Caxias do Sul, RS, janeiro 2019, assumido como sendo Ganoderma sp.
Plantas de caquizeiro (inglês: Persimmon trees) (Diospyros kaki L.), pomar com ca. 4500 árvores e 22 anos de idade, Fazenda Souza, Caxias do Sul, RS, com folhas verdes amareladas, progredindo para amarelas e cuminando com a morte da planta, ao longo de 3-4 anos. O fruticultor informou que ao sacudir as árvores mais atingidas percebe-se que estão “soltas” (raízes mortas). Não verificou associação das plantas sintomáticas e locais mais úmidos ou com a topografia. O corte da casca dos ramos e caule não mostraram tecido escurecido (cancro). O fruticultor foi instruído a retirar algumas raízes na sombra da copa, sacudir para tirar o excesso de solo, e enviar em torno de 500 g de amostra de mais de um local (Protocolo 127486). O resultado das análises do material descrito acima indicou tratar-se de podridão branca (Varnis fungus rot), causada pelo fungo Ganoderma sp. Este fungo degrada lignina e celulose, afetando o xilema, logo, observa-se murcha, amarelecimento e declínio das plantas.
A remoção e destruição das partes doentes da planta e restos da cultura da área são essenciais no manejo da podridão branca de ganoderma. O controle biológico utilizando os fungos Trichoderma harzianum, T. virens e Chaetomium globosum também é recomendado.
Observação: Não há relato deste fungo causando doença em caquizeiro, mas há em palmeiras, mangueira e várias árvores (Cercis sp., Ilex verticillata, Platanus x acerifolia, Quercus imbricaria...). Não se realizou os Postulados de Koch e o fruticultor não viu cogumelos tipo orelha-de-pau, corpo de frutificação de Ganoderma, em plantas mortas, mas não visitamos a área.
Ganoderma Root Rots (Missouri Botanical Garden): As árvores afetadas pela podridão do fungo Ganoderma sp. podem apresentar folhas amareladas, murchas ou subdesenvolvidas e galhos mortos. O vigor das árvores pode diminuir à medida que a decomposição do tronco avança. O primeiro sinal visível de infecção é frequentemente a formação de corpos frutíferos (isolados ou em grupos) no tronco inferior e nas áreas expostas da raiz. Os corpos de frutificação são orelhas-de-pau: de aparência semelhante a prateleiras e até 135 cm de largura. A superfície superior da orelha-de-pau envernizada é tipicamente vermelha-marrom com uma borda branca, brilhante, e com uma aparência lacada. Ambas têm uma superfície branca porosa (quando fresca) na parte inferior. As árvores jovens, assim como as mais velhas e maiores, podem ser mortas por esta doença. Infelizmente, quando as orelhas-de-pau são notadas, é tarde demais para reverter a infecção. A taxa de decadência pode levar à morte em menos de 3 a 5 anos a partir do momento da infecção, e parece ser determinada pelo vigor das árvores, que é frequentemente influenciado por estresses ambientais.
Badalyan SM, Shnyreva A, Iotti M, Zambonelli A. Genetic resources and mycelial characteristics of several medicinal polypore mushrooms (Polyporales, Basidiomycetes). International Journal of Medicinal Mushrooms. 17(4): 371–384, 2015.
Ceresini P C; Costa-Souza, E; Zala, M; Furtado, E L; Souza, N L Evidence that the Ceratobasidium-like white-thread blight and black rot fungal pathogens from persimmon and tea crops in the Brazilian Atlantic Forest agroecosystem are two distinct phylospecies. Genet. Mol. Biol. [Internet]. 2012; 35( 2 ): 480-497. Disponível em: <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1415-47572012000300016> Acesso em: 10 jan.2019.
Elliott ML & Broschat TK. Ganoderma Butt Rot of Palms. Disponível em: <https://edis.ifas.ufl.edu/pdffiles/PP/PP10000.pdf>. Acesso em: 10.01.2019.
El-Marzoky, H. A. A new disease infected basal stem of mango trees caused by Ganoderma sp. in Egypt. J. Plant Prot. and Path., Mansoura Univ., Vol.5 (5): 579-593, 2014.
Mohanty PS, Harsh NSK, Pandey A. 2011. First report of Ganoderma resinaceum and G. weberianum from North India based on ITS sequence analysis and micromorphology. Mycosphere 2(4), 469–474.
Moyo, P., L. Mostert, M. Bester, e F. Halleen. 2016. Trunk Disease Fungi Associated With Diospyros kaki in South Africa. Plant disease 100 (12): 2383–93. Disponível em: <https://doi.org/10.1094/PDIS-02-16-0245-RE>. Acesso em: 10 jan.2019.
Paterson RRM (2007). Ganoderma disease of oil palm—A white rot perspective necessary for integrated control. Crop Protection, 26(9), 1369–1376.
Schwarze, F. W.M.R. & Ferner, D. (2003) Ganoderma on trees - differentiation of species and studies of invasiveness, Arboricultural Journal, 27:1, 59-77, 2012.
*******
How to cite: Gomes, L. B.; Andrade, C. C. L.; Duarte, V. Declínio de plantas de caquizeiro. Agriporticus. Disponível em: http://www.agronomicabr.com.br/agriporticus/detalhe.aspx?id=825. Acesso em: 14 jan.2019. (Atualize a data de acesso.)