Figura 1. Fruto de tomateiro de lavoura em Santa Teresa, Espírito Santo, submetido para análise pelo Técnico em Agropecuária Flávio César Loss, Syngenta, 02/06/021, positivo para Tomato chorotic spot virus (TCSV), tospovírus. As lesões causadas pelo tripes são suficientes para causar deformações, mas a presença do vírus acentua o problema.
Figura 2. Fruto de tomateiro de lavoura em Santa Teresa, Espírito Santo, submetido para análise pelo Técnico em Agropecuária Flávio César Loss, Syngenta, 02/06/021, positivo para Tomato chorotic spot virus (TCSV), tospovírus. As lesões causadas pelo tripes são suficientes para causar deformações, mas a presença do vírus acentua o problema.
Figura 3. Planta de tomateiro de lavoura em Santa Teresa, Espírito Santo, submetida para análise pelo Técnico em Agropecuária Flávio César Loss (autor da foto), Syngenta, 02/06/021, positivo para Tomato chorotic spot virus (TCSV), tospovírus.
Figura 4. Fruto de tomateiro de lavoura em Santa Teresa, Espírito Santo, submetido para análise pelo Técnico em Agropecuária Flávio César Loss, Syngenta, 02/06/021, positivo para Tomato chorotic spot virus (TCSV), tospovírus. As lesões causadas pelo tripes são suficientes para causar deformações, mas a presença do vírus acentua o problema.
Figura 5. Frutos de tomateiro de lavoura em Santa Teresa, Espírito Santo, submetidos para análise pelo Técnico em Agropecuária Flávio César Loss, Syngenta, 02/06/021, positivo para Tomato chorotic spot virus (TCSV), tospovírus. As lesões causadas pelo tripes são suficientes para causar deformações, mas a presença do vírus acentua o problema.
Figura 5. Frutos de tomateiro de lavoura em Santa Teresa, Espírito Santo, submetidos para análise pelo Técnico em Agropecuária Flávio César Loss, Syngenta, 02/06/021, positivo para Tomato chorotic spot virus (TCSV), tospovírus. As lesões causadas pelo tripes são suficientes para causar deformações, mas a presença do vírus acentua o problema.
Figura 7. Frutos de tomateiro, lavoura em Santa Teresa, Espírito Santo, positivos para Tomato chorotic spot virus (TCSV), tospovírus. Autor da foto: Técnico em Agropecuária Flávio César Loss, Syngenta, 02/06/021.
Figura 8. Frutos de tomateiro, lavoura em Santa Teresa, Espírito Santo, positivos para Tomato chorotic spot virus (TCSV), tospovírus. Autor da foto: Técnico em Agropecuária Flávio César Loss, Syngenta, 02/06/021.
Figura 9. Frutos de tomateiro, lavoura em Santa Teresa, Espírito Santo, positivos para Tomato chorotic spot virus (TCSV), tospovírus. Autor da foto: Técnico em Agropecuária Flávio César Loss, Syngenta, 02/06/021.
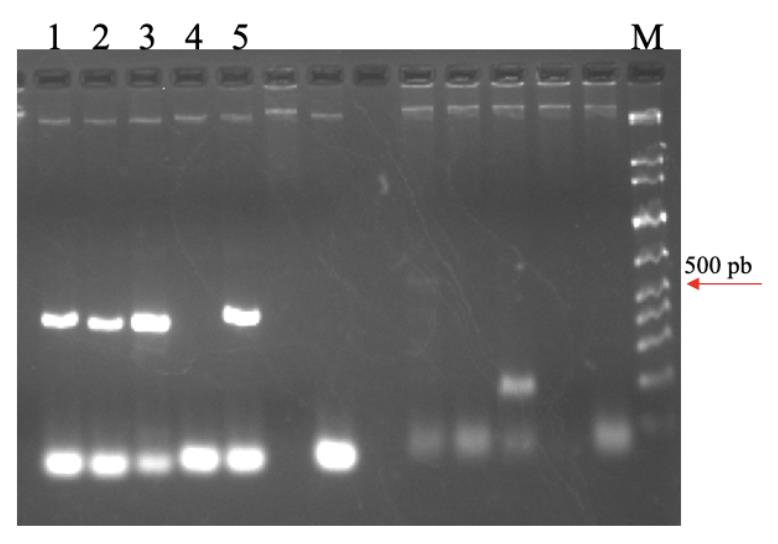
Figura 10. Padrão eletroforético em gel de agarose 1,5% de amostras amplificadas com primers para o gênero Tospovirus, resultando em um amplicon de 453 pb. Legendas 1, 2, 3: Amostras de tomateiro; 4: controle negativo; 5: Controle positivo; M: Marcador 1 kb Plus Ladder (Qiagen)
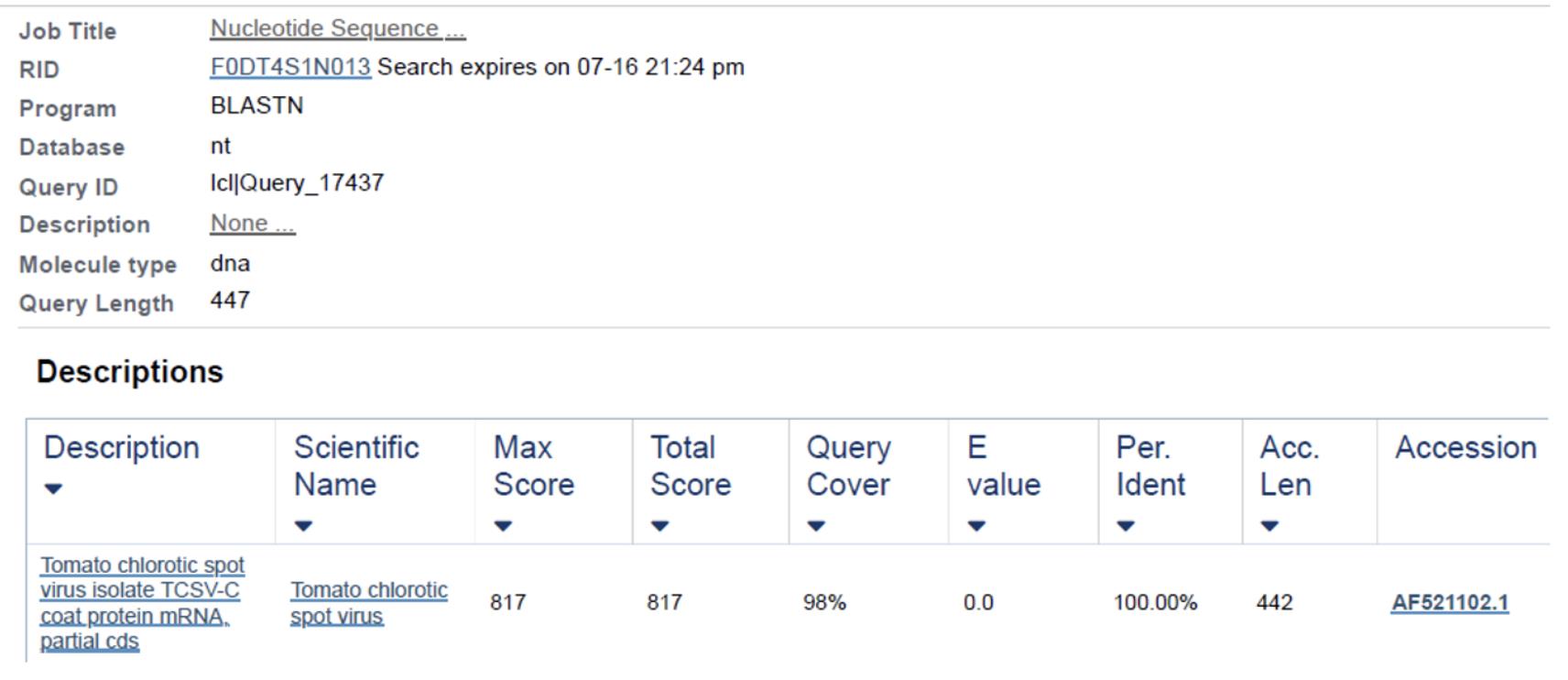
Figura 11. Resultado da comparação da sequência do fragmento obtido pela amplificação com os primers para tospovirus com o Acesso AF521102.1 do GenBank indicando 100% de similaridade (https://www.ncbi.nlm.nih.gov/nuccore/af521102.1)
Através da consulta do Técnico em Agropecuária Flávio César Loss, Syngenta, Santa Teresa, Espírito Santo, 2/06/021, recebemos primeiramente imagens e depois plantas de tomateiro com frutos com os sintomas ilustrados nas imagens acima.
Os resultados da RT-PCR deram positivo para o gênero Tospovirus e a sequência indicou tratar-se de Tomato chlorotic spot virus (TCSV), transmitido por espécies de tripes de ocorrência generalizada como a Frankliniella occidentalis e a F. schultzei.
Tripes pertencem à ordem dos insetos Thysanoptera. Eles são insetos pequenos e delgados, variando de 0,5 a 2 mm de comprimento. Os adultos da maioria das espécies têm asas em forma de faixa com uma ampla franja marginal de pelos (Persley, et al., 2007).
Todos os tospovírus são transmitidos por tripes. Os tospovírus não são transmitidos por outros insetos sugadores, como pulgões, cigarrinhas ou insetos mastigadores, por ex. besouros. O trelacionamento de ripes / tospovírus é muito específico e menos de 20 das espécies de tripes que se alimentam de plantas são portadoras ou vetores de tospovírus. Os tospovírus são transmitidos por apenas algumas dessas espécies (Persley, et al., 2007).
Os tospovírus não são disseminados nas sementes ou em equipamentos de corte, poda e cultivo. Os vírus não se espalham pelo manuseio de plantas e não sobrevivem no solo ou em resíduos de colheita em decomposição (Persley, et al., 2007).
Os tospovírus podem ser disseminados em partes de plantas infectadas usadas para propagação, como mudas, tubérculos e bulbos (Persley, et al., 2007).
No Brasil, as espécies relatadas em tomate são o Tomato spotted wilt virus (TSWV), Tomato chorotic spot virus (TCSV), Groundnut ringspot virus (GRSV) e o Chrysanthemum stem necrosis virus (CSNV), com particularidades na relação vírus-vetor e diferentes níveis de prevalência nas diversas regiões de cultivo, que é o caso da espécie TCSV nos estados de São Paulo e no Rio Grande do Sul ou do GRSV, em Minas Gerais e no Nordeste do Brasil (Colariccio et al., 2001).
IMPORTANTE: Ao coletar amostras de plantas para diagnóstico de vírus, selecione várias amostras que mostrem a gama de sintomas presentes. As amostras devem ser colocadas em sacos plásticos e mantidas em local fresco. Antes do transporte para o laboratório, as amostras devem ser embrulhadas em papel toalha úmido e colocadas dentro de um saco plástico. Envie amostras para O laboratório pelo meio mais rápido para reduzir o risco de deterioração. Ao contrário das amostras para diagnóstico de fungos, o tecido seco não é satisfatório para testes de diagnóstico de vírus.
MANEJO DE TOSPOVIRUS (Persley, et al., 2007)
Plantas infectadas não podem ser curadas. As medidas de controle visam prevenir ou reduzir os níveis de doenças nas plantações, removendo ou evitando fontes de infecção por vírus e minimizando a propagação por tripes.
Medidas de Higiene da Cultura / Lavoura. Plantios infectados velhos, infestadas por tripes, são a principal fonte de vírus e devem ser pulverizados contra os tripes e removidos o mais rápido possível, especialmente se novos cultivos forem estabelecidos nas proximidades.
Evite a sobreposição de semeaduras de culturas suscetíveis e sequências de lavouras no mesmo local ou lado a lado para minimizar a propagação do vírus de uma cultivo para a outra.
Ervas daninhas próximas das lavouras, canais de irrigação e em terras em pousio fornecem plantas hospedeiras para tripes e tospovírus.
Os níveis de doenças costumam ser mais altos nas fileiras das plantações adjacentes a essas áreas. As ervas daninhas em floração são particularmente atraentes para os tripes, pois se alimentam de pólen. Destrua as ervas daninhas bem antes do plantio, não quando as safras são plantadas, pois os tripes infectados com vírus podem migrar das ervas daninhas murchas para as plantas jovens.
Manter uma zona tampão limpa e livre de ervas daninhas a pelo menos 25 m entre uma fonte de vírus e uma cultura suscetível pode reduzir consideravelmente os níveis de vírus.
Controle de tripes com inseticida. Reduzir as populações de tripes pelo uso de inseticidas adequados pode ajudar a reduzir a disseminação do vírus. No entanto, os inseticidas são frequentemente de valor limitado no controle de tospovírus, uma vez que a disseminação do vírus de áreas sem cultivo é uma fonte importante de infecção e a alimentação do tripes por tempo limitado é o suficiente para a transmissão do vírus. Níveis significativos de doenças podem ocorrer quando o número de tripes é baixo e há poucas evidências de danos diretos na alimentação, pois um pequeno número de tripes que se deslocam para uma plantação pode resultar em transmissão significativa do vírus. O uso frequente de inseticidas também pode levar ao desenvolvimento de resistência a inseticidas em populações de tripes.
Use mudas livres de vírus. Os vírus podem ser introduzidos em mudas infectadas que, então, fornecem uma fonte de vírus ao longo da vida da cultura. As áreas de produção de mudas devem estar localizadas bem longe das lavouras, mantidas livres de ervas daninhas e sistematicamente monitoradas quanto a pragas e doenças com um programa de pulverização regular.
Tela à prova de tripes ou plástico absorvente de UV fornece um nível mais alto de proteção para a produção de mudas.
Variedades resistentes. Variedades de Capsicum e tomate resistentes ao TSWV estão disponíveis. A resistência opera pelas células da folha em torno do ponto de inoculação do vírus, morrendo e impedindo o movimento do vírus da área imediata. Embora eficaz, a resistência é controlada por genes dominantes únicos (denominados Sw-5 no tomate e Tsw no Capsicum) e é vulnerável ao desenvolvimento de cepas que quebram a resistência de TSWV. Isso é mais provável de ocorrer quando os genes de resistência são desafiados pela alta pressão do vírus, proporcionando assim uma maior oportunidade para a seleção e estabelecimento de cepas que quebram a resistência. Quando variedades resistentes são utilizadas, deve-se ter cuidado com a higiene da lavoura e outras medidas preventivas para reduzir as fontes de vírus e prolongar a vida útil das fontes de resistência.
Variedades resistentes são parte de uma estratégia de manejo, não uma razão para ignorar outros meios vitais de redução dos reservatórios e disseminação do vírus.
Referências
Adegbola, R. O.; Kemerait, R. C.; Adkins, S. & Naidu, R. A. 2019. Complete Genome Segment Sequences of Tomato Chlorotic Spot Virus from Peanut in Haiti. Microbiol Resour Announc. 8 Disponível em: http://dx.doi.org/10.1128/MRA.00306-19.
Almeida, M. M. S.; Orílio, A. F.; Melo, F. L.; Rodriguez, R.; Feliz, A.; Cayetano, X.; et al. 2014. The First Report of Tomato chlorotic spot virus (TCSV) Infecting Long Beans and Chili Peppers in the Dominican Republic. Plant Dis. 98:1285 Disponível em: http://dx.doi.org/10.1094/PDIS-04-14-0348-PDN.
Baker, C. A. & Adkins, S. 2015. First Report of Tomato chlorotic spot virus in Hoya wayetii and Schlumbergera truncata. Plant Health Prog. 16:29–30 Disponível em: https://doi.org/10.1094/PHP-BR-14-0043.
Batuman, O.; Rojas, M. R.; Almanzar, A. & Gilbertson, R. L. 2014. First Report of Tomato chlorotic spot virus in Processing Tomatoes in the Dominican Republic. Plant Dis. 98:286 Disponível em: http://dx.doi.org/10.1094/PDIS-07-13-0685-PDN.
Baysal-Gurel, F.; Li, R.; Ling, K.-S. & Miller, S. A. 2015. First Report of Tomato chlorotic spot virus Infecting Tomatoes in Ohio. Plant Dis. 99:163 Disponível em: http://dx.doi.org/10.1094/PDIS-06-14-0639-PDN.
Breuil, S.; Cañizares, J.; Blanca, J. M.; Bejerman, N.; Trucco, V.; Giolitti, F.; et al. 2016. Analysis of the coding-complete genomic sequence of Groundnut ringspot virus suggests a common ancestor with Tomato chlorotic spot virus. Arch. Virol. 161:2311–2316 Disponível em: http://dx.doi.org/10.1007/s00705-016-2912-x.
Colariccio, A.; Eiras, M.; Chaves, A. L. R.; Roggero, P.; Chagas, C. M. Diversidade de tospovírus em diferentes regiões produtoras de olerícolas do Estado de São Paulo. Summa Phytopathologica, Jaguariúna, v. 27, n. 2, p. 177-182, 2001.
Colariccio, A.; Eiras, M.; Chaves, A. L. R.; Harakava, R. & Chagas, C. M. 2004. Tomato chlorotic spot virus in hydroponically-grown lettuce in São Paulo State, Brazil. Fitopatologia Brasileira. 29:307–311 Disponível em: http://dx.doi.org/10.1590/s0100-41582004000300012.
Eiras, M.; Chaves, A. L. R.; Colariccio, A.; Harakava, R.; Araujo, J. D. E. & Chagas, C. M. 2002. Caracterização do Tomato chlorotic spot virus isolado de jiló no Vale do Paraíba, Estado de São Paulo. Fitopatol. Bras. 27:285–291 Disponível em: http://www.scielo.br/j/fb/a/rGDPk7fhVQ3GFxQBWX8WWGL/?lang=pt&format=pdf. Acesso em: 16.Jul.2021.
INRAE - French National Research Institute for Agriculture, Food and Enviroment. 2021. Tomato - Thrips - Final diagnosis. Ephytia INRA. Disponível em: https://ephytia.inra.fr/en/D/553. Acesso em: 16.Jul.2021.
Jensen, C. E. & Adkins, S. 2014. First Report of Tomato chlorotic spot virus in Lettuce in Puerto Rico. Plant Dis. 98:1015 Disponível em: http://dx.doi.org/10.1094/PDIS-12-13-1200-PDN.
Jensen, C. E. de; de Jensen, C. E.; Funderburk, J. E.; Skarlinsky, T. & Adkins, S. 2019. First Report of Tomato chlorotic spot virus in Soybean (Glycine max). Plant Disease. 103:2701 Disponível em: http://dx.doi.org/10.1094/pdis-05-19-0979-pdn.
Khan, R. A.; Seal, D. R.; Zhang, S.; Liburd, O. E.; Srinivasan, R. & Evans, E. 2020. Distribution Pattern of Thrips (Thysanoptera: Thripidae) and Tomato chlorotic spot virus in South Florida Tomato Fields. Environ. Entomol. 49:73–87 Disponível em: http://dx.doi.org/10.1093/ee/nvz153.
Kisker, B. 2016. O complexo do Vira-cabeça do tomateiro: epidemiologia e manejo. Disponível em: https://www.seminis.com.br/o-complexo-vira-cabeca-tomateiro-epidemiologia-e-manejo/. Acesso em: 16.Jul.2021.
Lima, M. F. & Filho, M. M. 2015. Vira-cabeça do Tomateiro: Sintomas, Epidemiologia, Transmissão e Medidas de Manejo - Comunicado Técnico 110. Embrapa Hortaliças. Disponível em: https://ainfo.cnptia.embrapa.br/digital/bitstream/item/131429/1/COT-110.pdf. Acesso em: 16.Jul.2021.
Londoño, A.; Capobianco, H.; Zhang, S. & Polston, J. E. 2012. First record of Tomato chlorotic spot virus in the USA. Trop. Plant Pathol. 37:333–338 Disponível em: https://www.scielo.br/j/tpp/a/jnhbfVFnqF3RLR4jqs7LZdf/abstract/?lang=en&format=html. Acesso em: 16.Jul.2021.
Martínez, R. T.; de Almeida, M. M. S.; Rodriguez, R.; de Oliveira, A. S.; Melo, F. L. & Resende, R. O. 2018. Identification and genome analysis of Tomato chlorotic spot virus and dsRNA viruses from coinfected vegetables in the Dominican Republic by high-throughput sequencing. Virol. J. 15:24 Disponível em: http://dx.doi.org/10.1186/s12985-018-0931-9.
Martínez Zubiaur, Y.; Chang Sidorchuk, L.; González Alvarez, H.; Barboza Vargas, N. & González Arias, G. 2016. First molecular evidence of Tomato chlorotic spot virus infecting tomatoes in Cuba. Disponível em: https://core.ac.uk/download/pdf/162569158.pdf.
Persley, D.; Sharman, M.; Thomas, J.; Kay, I.; Heisswolf, S. & McMichael, L. 2007. Thrips and Tospovirus: A Management Guide. Cooperative Research Centre for Tropical Plant Protection - The State of Queensland, Department of Primary Industries and Fisheries. Disponível em: https://ausveg.com.au/app/data/technical-insights/docs/TL151.pdf. Acesso em: 16.Jul.2021.
Silva, J. M. F.; de Oliveira, A. S.; de Almeida, M. M. S.; Kormelink, R.; Nagata, T. & Resende, R. O. 2019. Tomato chlorotic spot virus (TCSV) Putatively Incorporated a Genomic Segment of Groundnut ringspot virus (GRSV) Upon a Reassortment Event. Viruses. 11 Disponível em: http://dx.doi.org/10.3390/v11020187.
Webster, C. G.; Frantz, G.; Reitz, S. R.; Funderburk, J. E.; Mellinger, H. C.; McAvoy, E.; et al. 2015. Emergence of Groundnut ringspot virus and Tomato chlorotic spot virus in Vegetables in Florida and the Southeastern United States. Phytopathology. 105:388–398 Disponível em: http://dx.doi.org/10.1094/PHYTO-06-14-0172-R.
Webster, C. G.; de Jensen, C. E.; Rivera-Vargas, L. I.; Rodrigues, J. C. V.; Mercado, W.; Frantz, G.; et al. 2013. First Report of Tomato chlorotic spot virus (TCSV) in Tomato, Pepper, and Jimsonweed in Puerto Rico. Plant Health Prog. 14:47 Disponível em: https://doi.org/10.1094/PHP-2013-0812-01-BR.
*******
How to cite: Mituti, T.; Pereira, W.V.; Dalbosco, M.; Duarte, V. Deformação de Frutos de Tomateiro: Tripes e TCSV. Agriporticus. Disponível em: http://www.agronomicabr.com.br/agriporticus/detalhe.aspx?id=1996. Acesso em: 16.jul.2021 (Atualize a data de acesso.)